- 中文
- English
/




|
| 委托生產/委托開發生產 CMO/CDMO |
| 質量體系咨詢 |
| 風險管理 |
| 醫療器械軟件確認 |
| 工藝設計開發/設計轉化 |
| 設計驗證/確認策劃 |
| 生物學評價 |
| 臨床前動物實驗 |
| 重復使用再處理確認 |
| 產品性能測試/注冊檢測 |
| 人因工程/可用性評價 |
| 微生物試驗 |
| 網絡安全測試 |
| 包裝驗證和有效期驗證 |
| 電氣安全測試 |
| EMC測試 |
| 臨床評價 |
| 法規和標準培訓 |
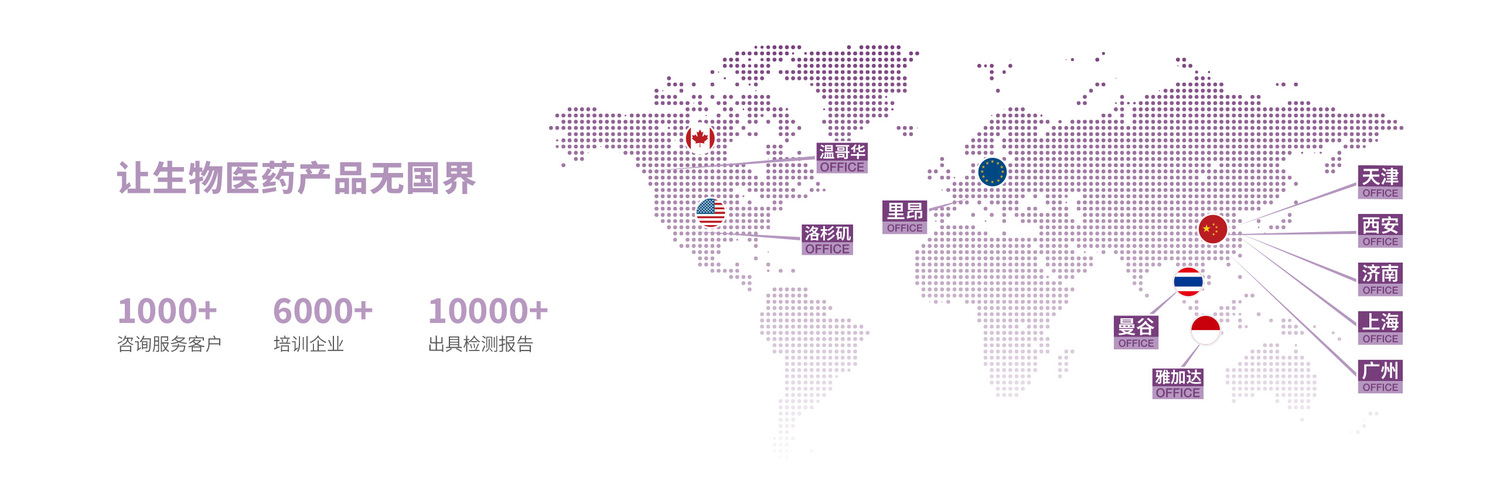
| 中國 醫療器械注冊證申報 |
| 美國 510(k) 申請 |
| 美國 De NOVO / PMA |
| 歐盟 CE 認證咨詢 / 英國 UKCA 認證咨詢 |
| 俄羅斯注冊咨詢 / 獨聯體國家注冊咨詢 |
| 加拿大 醫療器械許可證申請 |
| 巴西 ANVISA 注冊 |
| 質量體系檢查支持 |
| 當地代表服務 |
| 上市后臨床跟蹤 |
| 不良事件處理 |
| 召回服務 |
| 產品變更/迭代法規調研和規劃 |
| 注冊/認證變更 |
| 產品退市服務 |
2025年7月20日(周日)17:00-18:00天津新聞廣播《一起天津》將迎來一場聚焦產業前沿的深度對話。天津市政協委員、天津海河生物醫藥科技集團創始人兼董事長洪曉鳴女士被譽為“生物醫藥CRO出海領航者”的行業領軍人物特約受邀做客節目,將與其他嘉賓圍繞“國際盛會下,天津生物醫藥企業的新契機”,共探產業升級與國際化之路,歡迎關注!洪曉鳴女士作為生物醫藥領域的杰出代表,在行業內有著豐富的實踐經...
海河要聞
更多>>
海河生物服務平臺巡展—化學分析和毒理學評價平臺原創 海河生物 海河生物視界 2025年06月24日 17:55 天津化學分析和毒理學評價平臺海河生物作為行業領先的生物醫藥合同研究組織(CRO),構建了覆蓋材料表征 - 毒理評估 - 法規合規的一體化服務體系。 01核心技術優勢:硬實力與軟實力雙輪驅動1. 國際化硬件配置檢測設備矩陣:配備 GC-MS、LC-MS(QTOF)、ICP-OES、X...
為加強醫療器械注冊管理,規范注冊申請人自檢工作,國家藥監局組織起草了《醫療器械注冊自檢管理規定實施指南(征求意見稿)》,現向社會公開征求意見。 請填寫反饋意見表,并于2025年7月11日前反饋至ylqxzc @nmpa.gov.cn,電子郵件標題請注明“醫療器械注冊自檢管理規定實施指南反饋意見”。 附件:1.醫療器械注冊自檢管理規定實施指南.doc2.反饋意見表(模板).doc 國家藥...
關于我們海河生物是一家專業為醫療器械、藥品研發和生產企業提供全生命周期服務的公司。海河生物旗下檢測機構為集團全資子公司,全流程可控,是國內首家獲得國家級檢驗檢測資質認定的非公有制醫療器械檢測機構,也是我國最早提供整套同時符合中國藥監局和美國GLP標準的醫療器械臨床前研究的CRO公司,擁有多個國內獨占醫療器械測試平臺。檢測機構資質齊全,已獲得國家級檢驗檢測資質認定(CMA)、CNAS、美國AN...
海河生物邀您7月17日(周四)參加線上培訓,本次培訓以「藥械組合類產品NMPA和CE注冊要點」為核心,聚焦該類產品在國內外注冊申報中的關鍵難點與實操細節,助力企業精準把握合規路徑。報名方式可掃描或長按識別二維碼完成線上報名關于海河生物海河生物是一家專業為醫療器械和藥品相關的研究機構、研發和生產企業以及相關監管部門提供產品全生命周期服務的平臺性公司,在生物醫藥CRO領域具有極高的行...
海河咨詢:向客戶提供中國、美國、歐盟、巴西、加拿大和東南亞國家等國家地區的醫療器械、藥品和藥械結合產品全生命周期法規政策咨詢、注冊認證輔導、上市后不良事件處理、技術轉化、培訓等相關服務。海河CDMO:海河生物的醫療器械委托研發生產平臺,是按照國家藥監局醫療器械生產質量管理規范、美國藥監局 QSR 和 ISO13485 要求建立的為器械產學研、醫工轉化和初創型團隊服務的平臺,承接醫療器械產品定...
海河之光
更多>>
海河觀瞻
更多>>
慧聚海河
更多>>
海河學堂
更多>>
海河文庫
更多>>
|
|